The key difference between nitrate and nitrite is that nitrate contains three oxygen atoms bonded to a nitrogen atom whereas nitrite contains two oxygen atoms bonded to a nitrogen atom.
ביידע נייטרייט און ניטריטע זענען ינאָרגאַניק אַנאַנז וואָס באשטייט פון ניטראָגען און זויערשטאָף אַטאָמס. ביידע די אַניאַנז האָבן אַ -1 עלעקטריקאַל אָפּצאָל. זיי דער הויפּט אַקערז ווי די אַניאָן פון זאַלץ קאַמפּאַונדז. עס זענען עטלעכע דיפעראַנסיז צווישן נייטרייט און ניטריטע; מיר וועלן דיסקוטירן די דיפעראַנסיז אין דעם אַרטיקל.
וואָס איז נייטרייט?
נייטרייט איז אַן ינאָרגאַניק אַניאָן מיט די כעמיש פאָרמולע נאָוט3-. עס איז אַ פּאָליאַטאָמיק אַניאָן אַז האט 4 אַטאָמס; איין ניטראָגען אַטאָם און דריי זויערשטאָף אַטאָמס. דער אַניאָן האט -1 קוילעלדיק אָפּצאָל. די מאָלאַר מאַסע פון דעם אַניאָן איז 62 ג / מאָל. דער אַניאָן איז דערייווד פון זייַן קאָנדזשוגאַטע זויער; ניטריק זויער אָדער הנאָ 3. אין אנדערע ווערטער, נייטרייט איז די קאָנדזשוגאַטע באַזע פון די ניטריק זויער.
אין קורץ, נייטרייט יאָן האט איין ניטראָגען אַטאָם אין דעם צענטער וואָס ביינדז מיט דריי זויערשטאָף אַטאָמס דורך קאָוואַלענט כעמישער באַנדינג. ווען קאַנסידערינג די כעמישער סטרוקטור פון דעם אַניאָן, עס האט דרייַ יידעניקאַל קיין קייטן (לויט די אפקלאנג סטראַקטשערז פון דער אַניאָן). דערפאר, די דזשיאַמאַטרי פון די מאָלעקול איז טריגאָנאַל פּלאַנאַר. יעדער זויערשטאָף אַטאָם קאַריז א - 2/3 אָפּצאָל, וואָס גיט די קוילעלדיק אָפּצאָל פון די אַניאָן ווי -1.
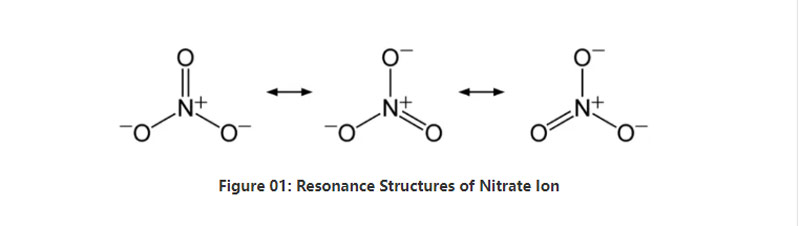
אין נאָרמאַל דרוק און טעמפּעראַטור, כּמעט אַלע די זאַלץ קאַמפּאַונדז מיט דעם אַניאָן צעלאָזן אין וואַסער. מיר קענען געפֿינען געוויינטלעך געשעעניש נייטרייט סאָלץ אויף דער ערד ווי דיפּאַזאַץ; ניטראַטינע דיפּאַזאַץ. דער הויפּט כּולל סאָדיום נייטרייט. דערצו, ניטראַפייינג באַקטיריאַ קענען פּראָדוצירן נייטרייט יאָן. איינער פון די הויפּט ניצט פון די נייטרייט סאָלץ איז אין דער פּראָדוקציע פון פערטאַלייזערז. דערצו, עס איז נוצלעך ווי אַ אַקסאַדייזינג אַגענט אין יקספּלאָוסיווז.
וואָס איז ניטריטע?
ניטריטע איז אַן ינאָרגאַניק זאַלץ מיט די כעמיש פאָרמולע נאָ 2-. דעם אַניאָן איז אַ סיממעטריק אַניאָן, און עס האט איין ניטראָגען אַטאָם באַנדאַד צו צוויי זויערשטאָף אַטאָמס מיט צוויי יידעניקאַל קיין קאָוואַלענט כעמישער קייטן. דערפאר, די ניטראָגען אַטאָם איז אין דעם צענטער פון די מאַלאַקיול. דער אַניאָן האט -1 קוילעלדיק אָפּצאָל.
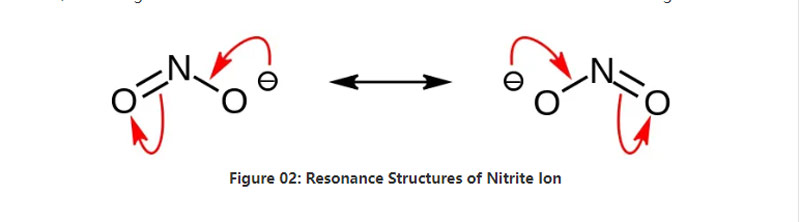
די מאָלאַר מאַסע פון די אַניאָן איז 46.01 ג / מאָל. דער אַניאָן איז דערייווד פון די ניטראָוס זויער אָדער הנאָ 2. דעריבער, עס איז די קאָנדזשוגאַטע באַזע פון די ניטראָוס זויער. דעריבער, מיר קענען פּראָדוצירן נייטרייט סאָלץ געגרינדעט דורך פאָרן ניטראָוס פיומז אין ייקוויאַס סאָדיום כיידראַקסייד לייזונג. דערצו, דאָס טראגט סאָדיום נייטרייט וואָס מיר קענען רייניקן דורך רעקריסטאַלליזאַטיאָן. אין די ניטריטע סאָלץ אַזאַ ווי סאָדיום ניטריטע זענען נוציק אין עסנוואַרג פּרעזערוויישאַן ווייַל עס קען פאַרמייַדן עסנוואַרג פון מייקראָוביאַל וווּקס.
וואָס איז די חילוק צווישן נייטרייט און ניטריטע?
נייטרייט איז אַן ינאָרגאַניק אַניאָן מיט די כעמיש פאָרמולע נומ 3- כוועראַז ניטריטע איז אַן ינאָרגאַניק זאַלץ מיט די כעמיש פאָרמולע נאָ 2-. דער ערשטיק חילוק צווישן נייטרייט און ניטריטע ליגט אויף די כעמישער זאַץ פון די צוויי אַנאַנז. דאָס איז; the key difference between nitrate and nitrite is that nitrate contains three oxygen atoms bonded to a nitrogen atom whereas nitrite contains two oxygen atoms bonded to a nitrogen atom. דערצו, נייטרייט יאָן איז דערייווד פון זייַן קאָנדזשוגאַטע זויער; די ניטריק זויער, בשעת די ניטריט יאָן איז דערייווד פון ניטראָוס זויער. ווי אן אנדער וויכטיק חילוק צווישן נייטרייט און נייטרייט ייאַנז, מיר קענען זאָגן אַז נייטרייט איז אַן אַקסאַדייזינג אַגענט ווייַל עס קענען אַנדערגאָו די בלויז רעדוקציע כוועראַז פון ניטריטע קענען שפּילן ווי ביידע אַקסאַדייזינג און רידוסט אַגענט.
פּאָסטן צייט: מאי -16-2022





